الشيخوخة ، كعملية بيولوجية معقدة تحدث طوال الحياة ، هي عامل أساسي في تطور مختلف الأمراض المزمنة ، خاصة المرتبطة بشكل كبير بخطر مرض الزهايمر (AD). ومع ذلك ، لا يزال يتعين توضيح آلياته الأساسية.
في استقلاب الطاقة العصبية ، ثلاثي فوسفات الغوانوسين (GTP) ، وهو جزيء رئيسي مشابه هيكليًا لـ ATP ، لا يشارك فقط في إمدادات الطاقة الخلوية ولكنه يلعب أيضًا دورًا حيويًا في صيانة اللدونة المتشابكة ، نقل الحويصلة ، وتنظيم البلعمة الذاتية. دراسة حديثة نشرت في علم الجراثيم من قبل فريق في جامعة كاليفورنيا ، ايرفين ، بعنوان "علاج الانخفاضات المرتبطة بالعمر في مستويات GTP يعيد الإلهام الخلوي والتهام الذاتي ،" يكشف أن انخفاض مستويات GTP في الخلايا العصبية أثناء الشيخوخة يضعف الإلتقام ووظائف الالتهام الذاتي.
باستخدام نموذج فأر مسن ، أظهرت الدراسة أن مكملات مدمجة مع نيكوتيناميد (ناد + سلائف ، شكل من فيتامين ب 3) وبوليفينول الشاي الأخضر (منشط Nrf2) استعادة مستويات GTP في الخلايا العصبية القديمة إلى حالات الشباب في غضون 16-24 ساعة. لم يحسّن هذا التدخل من الالتهام الخلوي والتهام الذاتي فحسب ، بل عزز أيضًا إزالة الأميلويد بيتا وزيادة معدلات البقاء على قيد الحياة العصبية من خلال ، مما قدم مقاربة جديدة للتدخل في الأمراض التنكسية العصبية المرتبطة بالشيخوخة.

قام فريق البحث من جامعة كاليفورنيا ، إيرفين ، بتحليل منهجي للتغيرات في مستويات GTP داخل الخلايا العصبية وتأثيراتها على الوظيفة الخلوية عبر مختلف الفئات العمرية (الشباب: 2-6 أشهر ، منتصف العمر: عمر 8-11 شهرًا: 17-28 شهرًا) باستخدام نموذج الفئران لمرض الزهايمر (الإعلان) والفئران التي تتحكم في الشيخوخة بشكل طبيعي. من خلال استخدام أجهزة استشعار الفلورسنت لمراقبة مستويات GTP في الخلايا الحية في الوقت الفعلي ، كشفت الدراسة أن:
تؤدي الشيخوخة إلى انخفاض كبير في مستويات GTP في الخلايا العصبية (خاصة في الميتوكوندريا) ، في حين تظهر الفئران نموذج الإعلان انخفاض شديد في GTP في وقت مبكر من منتصف العمر ، مما يشير إلى أن الإعلان قد يسرع ضعف استقلاب الطاقة.
كركيزة طاقة رئيسية للالبلعمة الذاتية ، تؤثر مستويات GTP بشكل مباشر على البلعمة الذاتية المثبطة للنشاط تؤدي إلى تراكم GTP ، في حين أن تنشيط البلعمة الذاتية يسرع استهلاك GTP.
مع التقدم في السن ، تتراكم GTPases المرتبطة بالتهام الذاتي (مثل Rab7 و Arl8b) بشكل غير طبيعي في الخلايا العصبية ، والتي قد تترافق مع ضعف نقل الحويصلة الناجم عن نقص GTP.
التدخل المشترك مع نيكوتيناميد (سلائف ناد) وبوليفينول الشاي الأخضر (منشط Nrf2) يمكن استعادة مستويات GTP في الخلايا العصبية القديمة إلى مستويات الشباب في غضون 16-24 ساعة.
يقلل هذا العلاج بشكل كبير من عدد وحجم حويصلات الرابيجيك 7/، مما يدل على قدرتها على تحسين وظيفة الليزوزومية الذاتية من خلال استعادة توازن GTP.
لا تكشف هذه الدراسة عن آليات مشتركة لضعف التمثيل الغذائي للطاقة في الشيخوخة ، ولكنها توفر أيضًا دليلًا تجريبيًا لاستراتيجيات الوقاية العصبية الموجهة للأيض GTP.
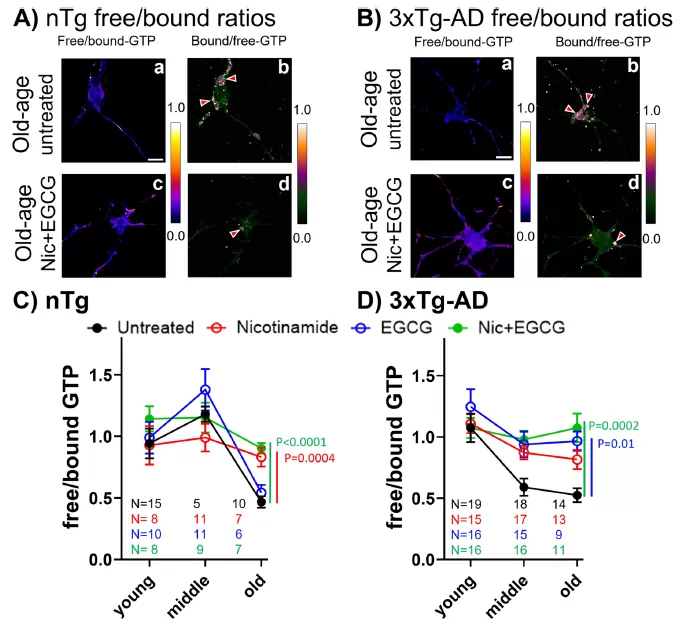
(علاج نيكوتيناميد + EGCG يستعيد مستويات GTP العصبية)
علاوةً على ذلك ، عزز العلاج المركب أيضًا تطهير بروتين الأميلويد بيتا داخل الخلايا ، وانخفاض مستويات أكسدة البروتين ، وزيادة معدلات البقاء على قيد الحياة للخلايا العصبية بواسطة. تثبت هذه النتائج أن استعادة مستويات GTP تسهل إزالة Aβ والبروتينات التالفة بشكل مؤكسد.
لاحظ فريق البحث أن هذه الدراسة تمثل أول توضيح منهجي للدور التنظيمي الحاسم لعملية التمثيل الغذائي في الشيخوخة وتطور مرض الزهايمر (الإعلان). ومع ذلك ، بما أن البحث الحالي يعتمد في المقام الأول على تجارب الخلايا المختبرية ، فإن ترجمتها السريرية لا تزال تتطلب مزيدًا من التحقق من خلال النماذج الحيوانية والتجارب السريرية البشرية.
أبرزها ، سريرية حديثةوجدت التجربة التي أجرتها جامعة كاليفورنيا أن نيكوتيناميد الذي يُدار عن طريق الفم عرضة للتثبيط الحيوي في مجرى الدم ، مما يحد من فعاليته العلاجية. تشير هذه النتيجة إلى أن الأبحاث المستقبلية تحتاج إلى تحسين طرق توصيل الدواء أو تطوير أنظمة توصيل أدوية أكثر استقرارًا لتحسين كفاءة العلاج.
على الرغم من هذه التحديات ، تحمل هذه الدراسة قيمة نظرية كبيرة. لا يكشف فقط عن الدور المركزي لتوازن GTP في الأمراض التنكسية العصبية ولكنه يضع أيضًا أساسًا علميًا لتطوير استراتيجيات التدخل الجديدة. توفر هذه الاكتشافات أهدافًا علاجية محتملة لتأخير أو وقف أو حتى عكس العمليات المرضية للشيخوخة.
المراجع:
https://doi.org/10.1007/s11357-025-01786-4